Cambios de pH en la electrolisis
133
About :
Saludos estimados amigos.
Como han visto, con el uso del indicador es fácil identificar los cambios de pH que ocurre en torno a los electrodos. Analicemos un poco más la situación.
Como ya sabemos, en la electrolisis se produce una reacción química al aplicar corriente eléctrica en una disolución, haciendo que en ambos electrodos se produzcan reacciones de óxido-reducción.
En la siguiente imagen se representa lo que ocurre en el cátodo durante la electrolisis de la disolución acuosa de NaCl, la cual se encuentra disociada en Na+ y Cl-.
Reacción en el cátodo. Fuente: @emiliomoron.
Al establecerse el circuito los iones sodio (Na+) se dirigirán hacia el cátodo, pero no sufren ninguna reacción ya que el potencial de reducción de la reacción de reducción del hidrógeno es más alto, y esta es la que se lleva a cabo en preferencia.
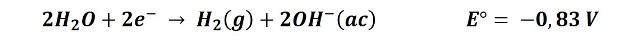
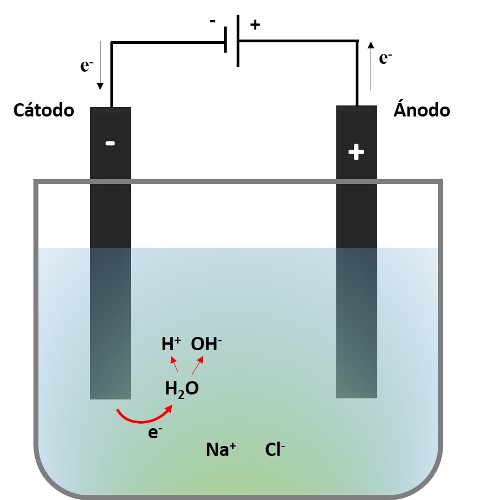
Lo que observamos en el video es que un electrón se transfiere desde el cátodo a una molécula de agua liberando un Hidrogeno atómico, y con el hidrógeno liberado de otra molécula de agua, se unen para formar una molécula de hidrogeno gaseoso y los iones hidroxilos (OH-) que le confieren el carácter básico a la solución, por lo que en esta zona aumenta el pH.
En el ánodo sin embargo el proceso puede resultar un poco más complejo, ya que existen dos reacciones en competencia.
1- La oxidación del oxígeno del agua para formar oxígeno gaseoso:
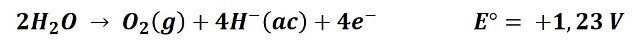
2- La oxidación del ion cloro para formar cloro gaseoso:
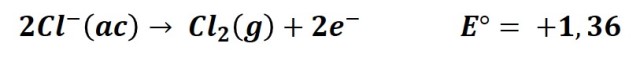
Que se dé la primera o la segunda reacción es un tanto difícil de predecir ya que el valor del potencial de reducción de ambas reacciones es muy próximo. Sin embargo podemos presumir que disoluciones diluidas conducirán a la primera reacción, liberando oxígeno y en disoluciones concentradas la tendencia es que se produzca cloro.
Entonces, considerando que estamos trabajando con una disolución diluida de NaCl; en la siguiente imagen se representa el proceso que ocurre en el ánodo.
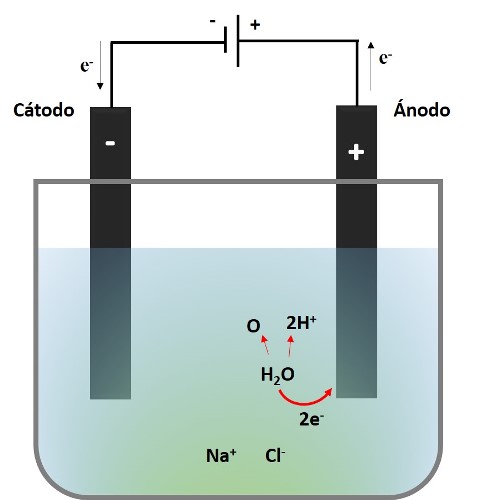
Reacción en el ánodo. Fuente: @emiliomoron.
Lo que vemos es que dos electrones del oxígeno del agua se transfieren al ánodo, el oxígeno monoatómico se combinará con otro oxígeno monoatómico y se liberara en forma de gas, mientras que los iones hidronio (H+) liberados le confieren el carácter ácido a esta zona en la disolución.
Bueno amigos, la divulgación de este material audiovisual es muy importante para visualizar de forma clara los procesos de óxido-reducción que se llevan a cabo durante la electrolisis de una disolución de NaCl, pudiendo ser utilizado por docentes y estudiantes como material de consulta y apoyo didáctico, o como una guía para llevar a cabo la reacción en el hogar o en el aula, ya que requiere de muy pocos materiales y todos son muy fáciles de conseguir, además, de que se logran resultados muy visibles que ayudan a fijar los conocimientos impartidos en el aula.
Espero les haya gustado este sencillo pero interesante experimento. Hasta la próxima.
Referencias
Wikipedia.com. Tabla de potenciales de reducción.
Tags :
Their limit for today is $0!


























Comments:
Reply:
To comment on this video please connect a HIVE account to your profile: Connect HIVE Account